Венеролог
Макарычев И.С.
Прием онлайн
Венеролог
Макарычев И.С.
Прием онлайн
Биологическая терапия Крапивницы в Нижнем Новгороде
Данная статья рассказывает о биологической терапии крапивницы при помощи генно-инженерных биологических препаратов (ГИБП) - наиболее современном методе лечения. Подробнее о крапивнице можно прочитать здесь.
Лечение крапивницы при помощи биологических препаратов в Нижнем Новгороде
На территории Нижнего Новгорода лечением крапивницы омализумабом занимается НГФ ФГБУ "ГНЦДК" Минздрава России (ул. Ковалихинска 49г). Препараты возможно получить по квоте при наличии показаний к лечению. Каждый случай рассматривается индивидуально во время госпитализации. Для получения подробной информации можно написать мне удобным для вас способом:
Как работает биологическая терапия при крапивнице?
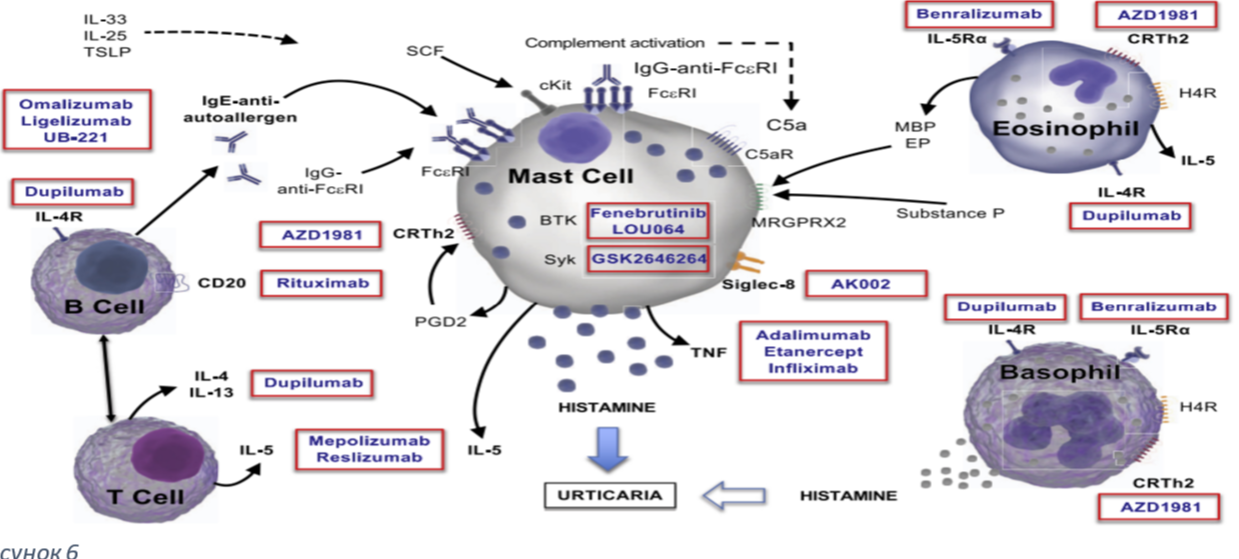
Омализумаб является единственным биологическим препаратом, лицензированным для лечения ХК на данный момент. Это рекомбинантное гуманизированное моноклональное антитело против IgE, одобренное для лечения резистентной к антигистаминным препаратам ХК у пациентов в возрасте 12 лет и старше.
Омализумаб снижает уровень циркулирующего IgE за счет связывания с доменом C3 тяжелой цепи IgE. Это приводит к последующему подавлению экспрессии FcεRI на тучных клетках и базофилах. Несколько систематических обзоров и метаанализов показывают, что лечение омализумабом приводит к значительному снижению активности заболевания и улучшению качества жизни у больных ХК. Омализумаб имеет хороший профиль безопасности и одобрен для самостоятельного применения в некоторых странах. Систематический обзор 43 исследований показал, что омализумаб эффективен у пациентов с рефрактерной к терапии ХК, особенно с бессимптомным дермографизмом, холодовой крапивницей и солнечной крапивницей.
Показания к назначению биологических препаратов.
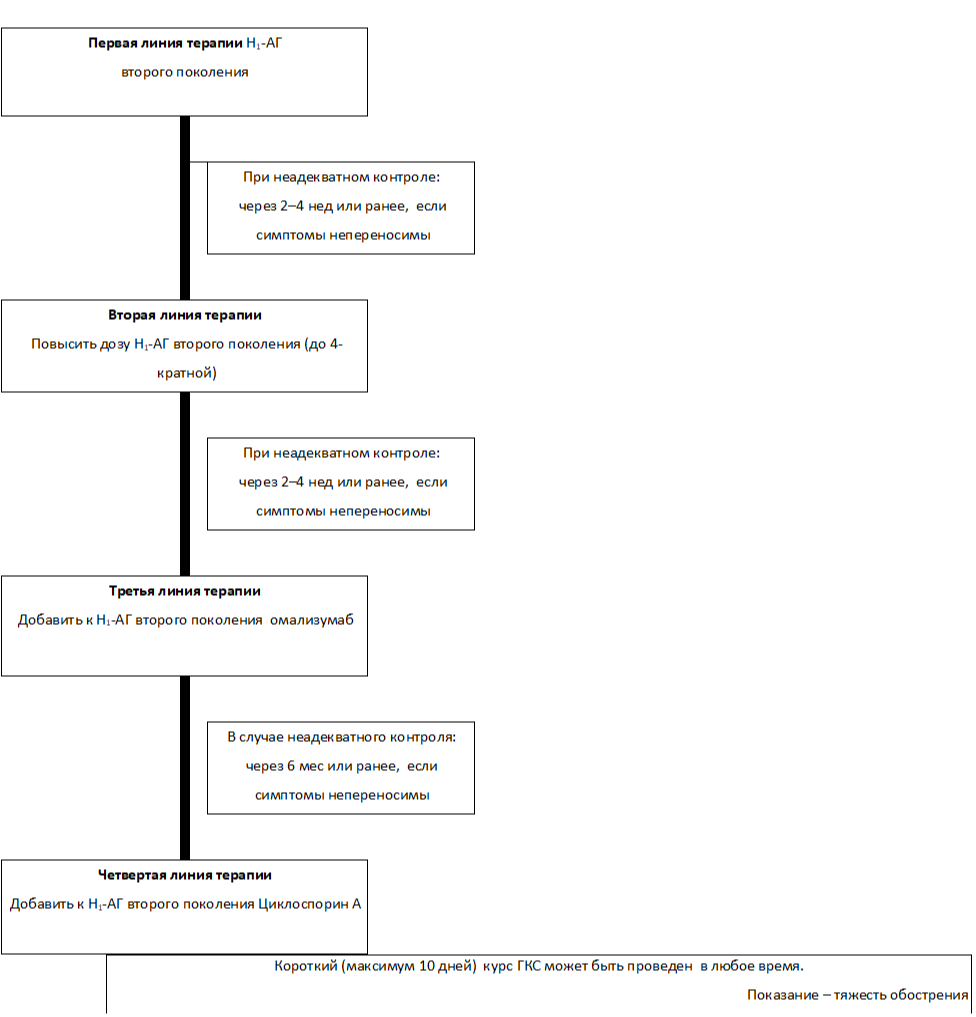
Показанием для назначения биологической терапии является неэффективность предыдущих двух ступеней:1. Ступень - стандартные дозировки антигистаминных препаратов.
2. Ступень - повышение дозировки антигистаминных препаратов до 4-х раз.
3. Ступень - присоединение биологической терапии.
4. Ступень - использование системных иммуносупрессоров.
Возможные побочные эффекты
Безопасность омализумаба при лечении хронической идиопатической крапивницы оценивали в трех плацебо-контролируемых клинических испытаниях c множественными дозами продолжительностью 12 нед (испытание 2) и 24 нед ( испытания 1 и 3).
В испытаниях 1 и 2 пациенты получали омализумаб в дозах 75, 150, или 300 мг или плацебо каждые 4 нед в дополнение к Н1-антигистаминной терапии на протяжении всего периода лечения. Пациенты в испытании 3 были рандомизированы на получение омализумаба в дозе 300 мг или плацебо каждые 4 нед в дополнение к Н1-антигистаминной терапии.
Представленные ниже данные отражают экспозицию омализумаба у 733 пациентов, участвовавших в трех клинических испытаниях и получивших по меньшей мере одну дозу омализумаба, включая 684 пациента, получавших лечение в течение 12 нед, и 427 пациентов — 24 нед. Средний возраст пациентов, получавших омализумаб в дозе 300 мг, составлял 43 года, 75% — женщины, 89% — пациенты европеоидной расы. Демографические профили пациентов, получавших омализумаб в дозе 75 и 150 мг, были схожи.
Побочные эффекты, которые встречались с частотой ≥2% у пациентов, получавших омализумаб (n=738), и более часто, чем у пациентов, получавших плацебо (с 1-го дня по 12-ю нед, n=717) в испытаниях 1, 2 и 3
Побочные эффекты приведены в соответствии с предпочтительными терминами и классификацией систем органов MedDRA. Результаты представлены следующим образом: рядом с названием побочного эффекта, через / указано количество пациентов, у которых был зафиксирован данный эффект (в скобках указана частота встречаемости этого эффекта в процентах) при применении омализумаба в дозе 150 мг (n=175), 300 мг (n=412) и плацебо (n=242).
Желудочно-кишечные расстройства: тошнота — 2 (1,1%)/ 11 (2,7%)/ 6 (2,5%).
Инфекции и инвазии: назофарингит — 16 (9,1%)/ 27 (6,6%)/ 17 (7%); синусит — 2 (1,1%)/ 20 (4,9%)/ 5 (2,1%); инфекции верхних дыхательных путей — 2 (1,1%)/ 14 (3,4%)/ 5 (2,1%); вирусные инфекции верхних дыхательных путей — 4 (2,3%)/ 2 (0,5%)/ (0%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия — 5 (2,9%)/ 12 (2,9%)/ 1 (0,4%).
Со стороны нервной системы: головная боль — 21 (12%)/ 25 (6,1%)/ 7 (2,9%).
Со стороны дыхательной системы, органов грудной клетки и средостения: кашель — 2 (1,1%)/ 9 (2,2%)/ 3 (1,2%).
Дополнительные реакции, о которых сообщалось в период 24-недельного периода лечения в испытании 1 и испытании 3 (у ≥2% пациентов, получавших омализумаб в дозе 150 или 300 мг, и более часто, чем у пациентов, получавших плацебо), включали следующие: зубная боль, грибковые инфекции, инфекции мочевыводящих путей, миалгия, боль в конечности, скелетно-мышечная боль, периферические отеки, повышение температуры тела, мигрень, синусовая головная боль, тревога, боль в ротоглотке, астма, крапивница, алопеция.
Как и при применении всех терапевтических белков, возможна потенциальная иммуногенность. Обнаружение образования антител во многом зависит от чувствительности и специфичности анализа. Кроме того, наблюдаемая частота положительных антител (включая нейтрализующие антитела) в анализе может зависеть от нескольких факторов, включая методологию анализа, обработку образцов, время сбора образцов, сопутствующие лекарства и основное заболевание. По этим причинам сравнение встречаемости антител к омализумабу в исследованиях, описанных ниже, с частотой встречаемости антител в других исследованиях или к другим продуктам может вводить в заблуждение.
Антитела к омализумабу были обнаружены примерно у 1/1723 (<0,1%) пациентов, применявших омализумаб в клинических исследованиях астмы у пациентов в возрасте 12 лет и старше. В трех педиатрических исследованиях антитела к омализумабу были обнаружены у одного пациента из 581 пациента в возрасте от 6 до 12 лет, получавших омализумаб, и оценены на наличие антител. У пациентов с хронической идиопатической крапивницей, получавших лечение в клинических испытаниях, антитела не обнаруживались, но из-за уровней омализумаба во время отбора образцов антител и отсутствия образцов для некоторых пациентов антитела к омализумабу могли быть определены только в 88% случаев. В этих клинических исследованиях прошли лечение 733 пациента. Данные отражают процент пациентов, чьи результаты тестов были признаны положительными на антитела к омализумабу в анализах ELISA, и сильно зависят от чувствительности и специфичности анализов.
Анафилаксия.
Из зарегистрированных случаев анафилаксии, приписываемой омализумабу, 39% произошли при использовании первой дозы, 19% — второй, 10% — третьей, а остальные — после последующих доз. Один случай произошел после 39 доз (после 19 мес непрерывной терапии произошла анафилаксия, когда лечение было возобновлено после 3-месячного перерыва). Время до начала анафилактической реакции в этих случаях составляло до 30 мин у 35%, больше 30 и до 60 мин у 16%, больше 60 и до 90 мин у 2%, больше 90 и до 120 мин у 6%, более 2 и до 6 ч в 5%, более 6 ч и до 12 ч в 14%, более 12 ч и до 24 ч в 8% и более 24 ч и более до 4 дней в 5%. В 9% случаев время начала было неизвестно.
Двадцати трем пациентам, у которых была анафилаксия, был повторно назначен омализумаб, и у 18 пациентов был рецидив аналогичных симптомов анафилаксии. Кроме того, анафилаксия произошла при повторном введении омализумаба у 4 пациентов, у которых ранее была только крапивница.
Беременость и прием омализумаба
Резюме рисков. Исследование реестра воздействия омализумаба во время беременности не показало увеличения частоты серьезных врожденных дефектов или выкидышей. Среди зарегистрированных младенцев была отмечена повышенная частота низкой массы тела при рождении по сравнению с младенцами в других когортах, несмотря на средний гестационный возраст при рождении; однако у женщин, применявших омализумаб во время беременности, также было более тяжелое течение астмы, что затрудняет определение того, связана ли низкая масса тела при рождении с омализумабом или тяжестью заболевания (см. Данные). Существуют риски, ассоциированные с плохо или умеренно контролируемой астмой во время беременности (см. Клинические аспекты).
Известно, что человеческие IgG-антитела проникают через плацентарный барьер, поэтому омализумаб может передаваться от матери развивающемуся плоду.
В исследованиях репродукции у животных не наблюдалось каких-либо доказательств вреда для плода у обезьян Cynomolgus при п/к введении омализумаба в дозах, примерно до 5 раз выше МРДЧ (см. Данные).
Анализы при лечении биологическими препаратами
Для назначений ГИБП необходимо обследование в объеме:
1. Общий анализ крови с лейкоцитарной формулой и СОЭ.
2. Биохимический анализ крови (общий белок, белковые фракции; мочевина; креатинин; билирубин общий; АсАТ, АлАТ; щелочную фосфатазу, глюкозу или гликированный гемоглобин).
3. Анализ крови на: HbsAg (гепатит В);anti-HCV (гепатит С); сифилис; ВИЧ-инфекцию.
4. Общий анализ мочи.
5. Консультация фтизиатра с заключением. Фтизиатру потребуется обследование:
- Проведение Диаскинтеста;
- Проведение рентгенографии органов грудной клетки в 2 проекциях и/или компьютерной томографии органов грудной клетки.
Для женщин консультация гинеколога для исключения беременности.
На фоне терапии обследование рекомендуется повторять каждые 6 месяцев.
Опыт применения других биологических препаратов.
Лигелизумаб представляет собой новое многообещающее гуманизированное моноклональное анти-IgE антитело, разрабатываемое для лечения пациентов с ХК. Он обладает в 40-50 раз большей аффинностью к IgE по сравнению с омализумабом. В многоцентровом РКИ фазы 2b пациенты с резистентной к антигистаминным препаратам ХК были рандомизированы в группы, получавшие 300 мг омализумаба, плацебо или 24, 72 или 240 мг лигелизумаба. Лигелизумаб продемонстрировал быстрое начало действия, дозозависимую эффективность и превосходство над омализумабом. Среднее время до рецидива после последней инъекции составило 4 недели для омализумаба против 10 недель для лигелизумаба. Плацебо, омализумаб и лигелизумаб имели сходные профили побочных эффектов, хотя 240 мг лигелизумаба вызывали более высокую частоту легких реакций в месте инъекции (6% против 2%).
Моноклональные антитела к Il-5.
Исследования показывают, что эозинофилы вносят вклад в патогенез ХК. Тучные клетки могут рекрутировать эозинофилы в очаги крапивницы, которые высвобождая ИЛ-5 и другие хемотаксические медиаторы поддерживают воспалительную реакцию. Отмечается связь между наличием эозинофилов и рефрактерностью к терапии гистоминоблокаторами. Меполизумаб и реслизумаб, mAb против IL-5, бенрализумаб - mAb против рецептора IL-5, успешно использовались для лечения у пациентов с ХК, но больших клинических исследований о применение данных препаратов обнаружено не было.
Моноклональное антитело против IL-4Rα
Lee и Simpson31 описали 6 пациенты с рефрактерной ХК, которые не реагировали на омализумаб в дозе от 300 до 600 мг, но положительно реагировали на дупилумаб.
Ингибиторы ФНО.
Sand и Thomsen сообщили о полном ответе после введения адалимумаба и этанерцепта у 15 из 25 пациентов с ХК (60%), некоторые из них были резистентны к омализумабу. Wilson и соавт. Лечили 6 пациентов с ХК ингибиторами ФНО-а адалимумабом, этанерцептом или инфликсимабом. У всех больных отмечалась полная ремиссия или частичное улучшение течения ХК, в большинстве случаев сохранявшееся в течение нескольких лет. РКИ отсутствуют.
Анти-CD20 mAb.
Ритуксимаб эффективен в нескольких случаях аутоиммунной ХК, рефрактерной к антигистаминным препаратам, омализумабу и/или иммуносупрессивной терапии. РКИ отсутствуют, а потенциальные побочные эффекты ритуксимаба ограничивают его использование при ХК.
Ингибиотры ИЛ-1.
РКИ по терапии, направленной на ИЛ-1 при ХК: по рилонацепту - растворимому трансфузионному белку рецептора ИЛ-1 используемому при холодовой крапивнице; по канакинумабу (гуманизированное моноклональное антитело против IL-1 длительного действия) при ХК еще не опубликованы.
Гуманизированное моноклональное антитело к Siglec-8
Siglec-8 представляет собой ингибиторный рецептор родственного CD33 семейства связывающих сиаловую кислоту иммуноглобулиноподобных лектинов. Селективная экспрессия Siglec-8 на поверхности тучных клеток, эозинофилов и базофилов при заболеваниях, связанных с тучными клетками, включая ХК и мастоцитоз является мишенью для терапии. AK002 – это гуманизированное моноклональное антитело к Siglec-8, ингибирует активность тучных клеток и истощает эозинофилы. Запущено открытое пилотное исследование безопасности и эффективности AK002 . В это исследование включены пациенты с ХК, ранее не применявшие омализумаб и рефрактерные к омализумабу, а также пациенты с холинергической крапивницей и пациенты с симптоматическим дермографизмом.
AZD1981: антагонист CRTh2
Простагландин D2, продукт активированных тучных клеток, индуцирует хемотаксис эозинофилов и базофилов посредством своего рецептора, гомологичной молекулы рецептора хемоаттрактанта, экспрессируемой на клетках TH2 (CRTH2). Предварительные результаты продолжающейся фазы 2 РКИ AZD1981, перорального антагониста CRTH2 (NCT02031679), показывают уменьшение зуда, о котором сообщают пациенты, снижение индуцированного простагландином D2e изменения формы эозинофилов и увеличение количества эозинофилов в крови у пациентов, получавших AZD1981, с антигистаминно-рефрактерной ХК.
Фенебрутиниб и LOU064: 2 ингибитора BTK
Тирозинкиназа Брутона (BTK) представляет собой фермент, участвующий в передаче сигнала после FcεRI и рецептора В-клеток. BTK необходим для FcεRI-опосредованной активации тучных клеток, а также для созревания и функции В-клеток. Лечение ингибитором BTK ингибирует реакции, опосредованные IgE и тучными клетками, у мышей и людей.
Фенебрутиниб (GDC-0853), мощный, селективный, нековалентный ингибитор BTK, в настоящее время проходит испытания в рамках многоцентрового РКИ фазы 2а у пациентов с резистентной к антигистаминным препаратам ХК.
Эффективность и безопасность другого ингибитора BTK, LOU064, в настоящее время оцениваются в многоцентровом РКИ фазы 2b с определением дозы у взрослых с резистентной к антигистаминным препаратам ХК. [13]