Венеролог
Макарычев И.С.
Прием онлайн
Венеролог
Макарычев И.С.
Прием онлайн
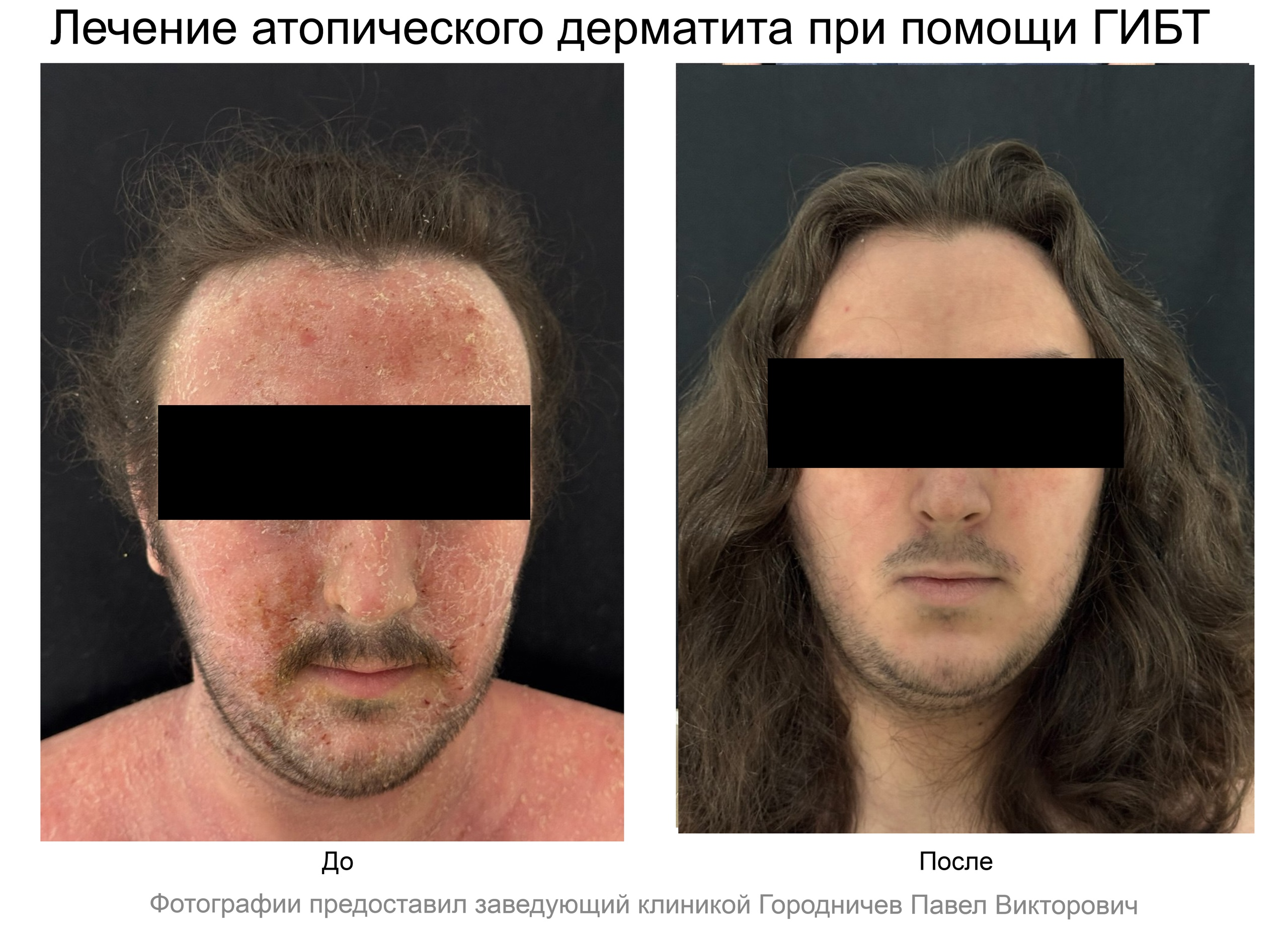
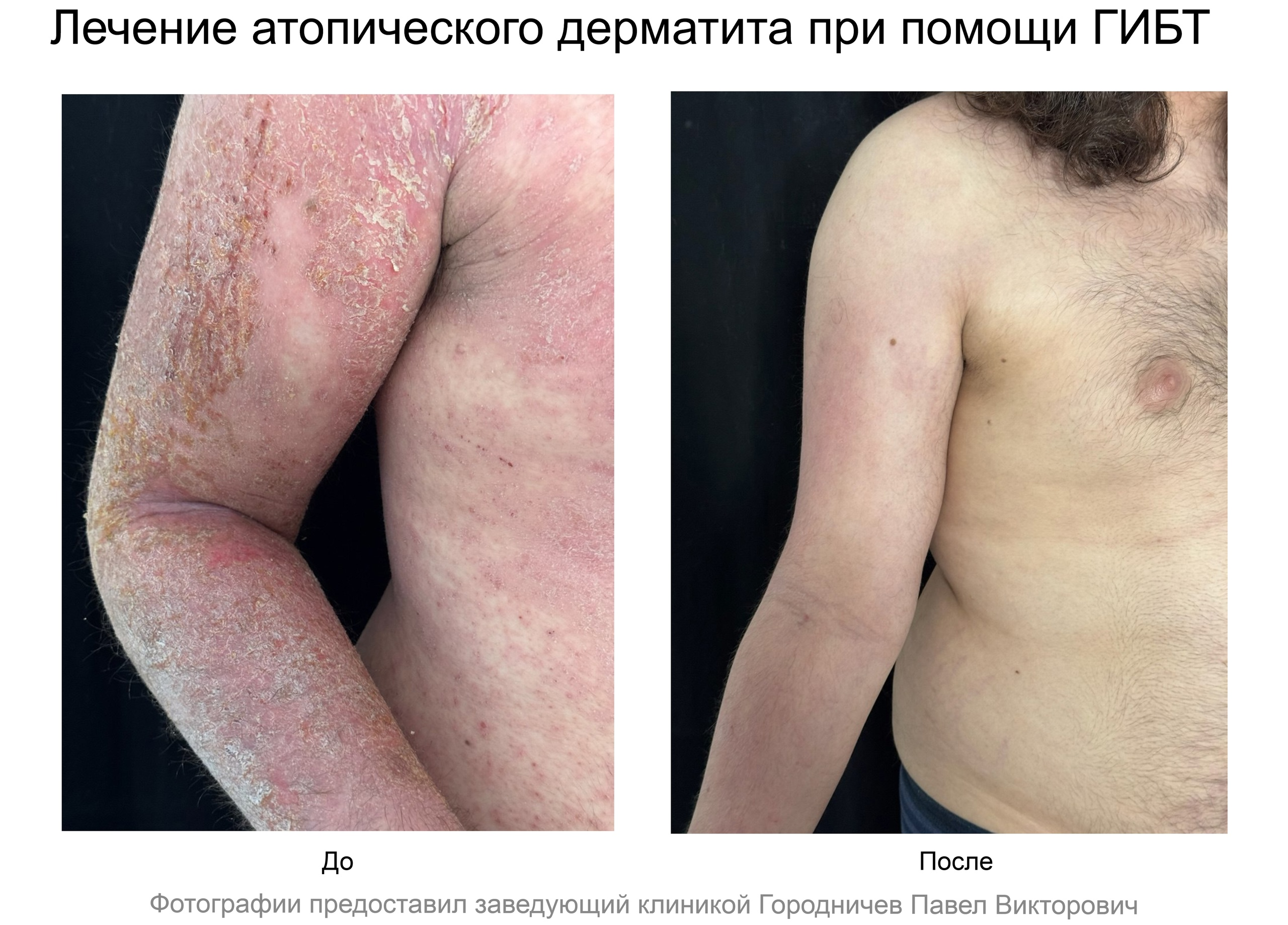
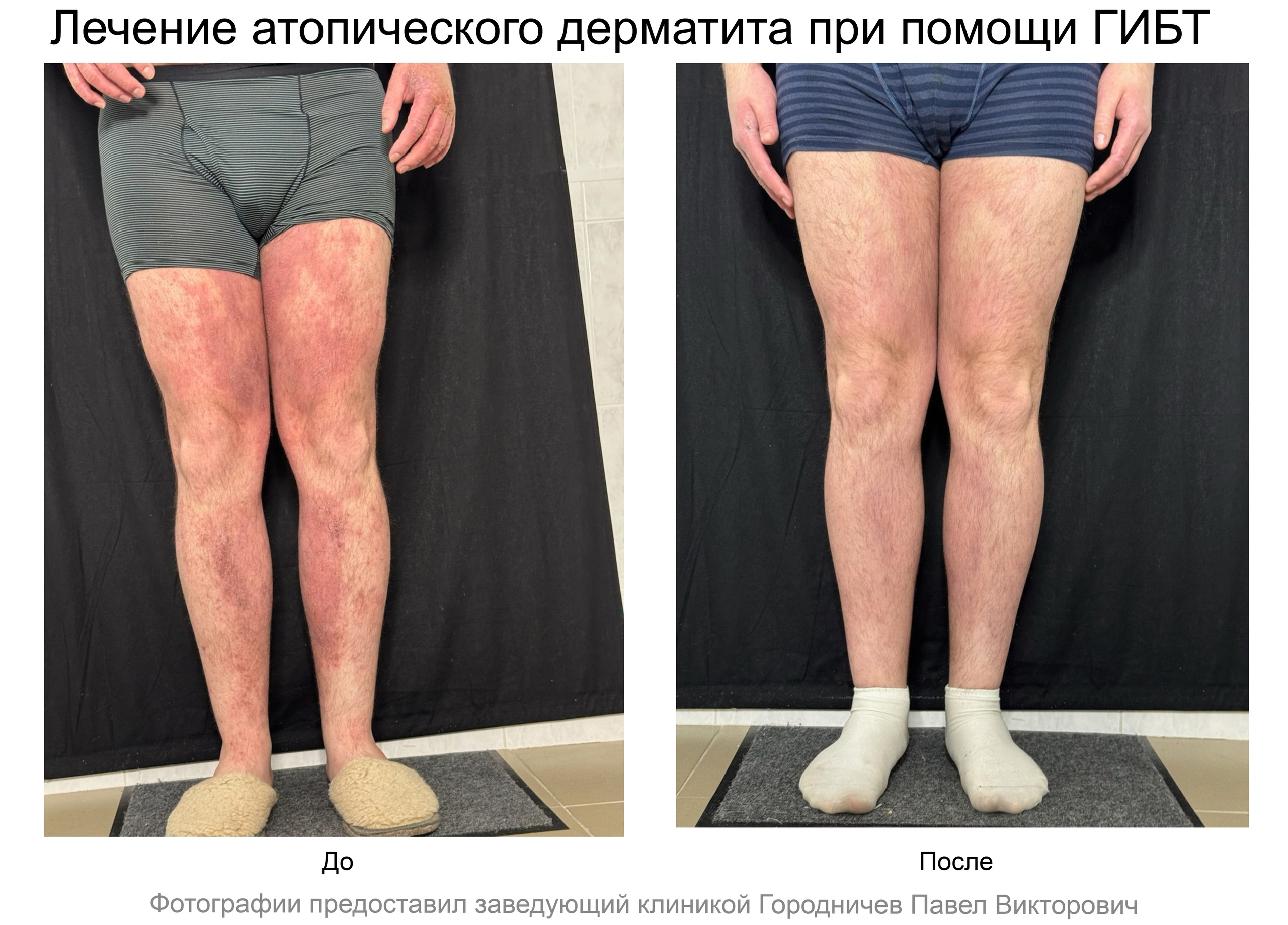
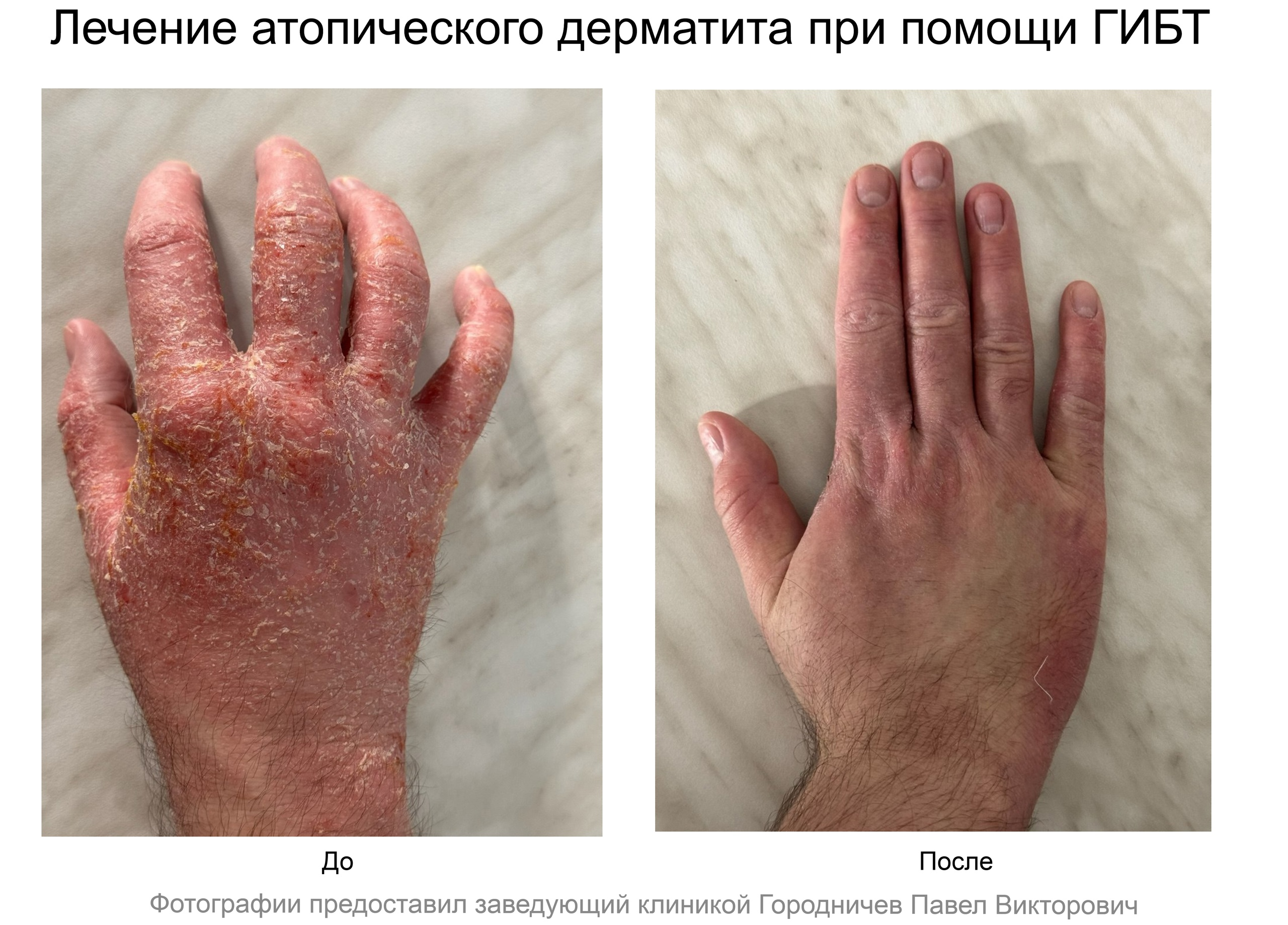
Биологическая терапия Атопического дерматита в Нижнем Новгороде
Данная статья рассказывает о биологической терапии атопического дерматита при помощи генно-инженерных биологических препаратов (ГИБП) - наиболее современном методе лечения. Подробнее об атопичеком дерматите можно прочитать здесь.
Лечение атопического дерматита при помощи биологических препаратов в Нижнем Новгороде
На территории Нижнего Новгорода лечением атопического дерматита при помощи биологических препаратов занимается НГФ ФГБУ "ГНЦДК" Минздрава России (ул. Ковалихинска 49г). Препараты возможно получить по квоте при наличии показаний к лечению. Каждый случай рассматривается индивидуально во время госпитализации. Для получения подробной информации можно написать мне удобным для вас способом:
Как работает биологическая терапия при атопическом дерматите?
Патогенез АД является многофакторным и включает взаимодействие дисфункции эпидермального барьера, иммунологических аномалий, генетических особенностей и факторов окружающей среды.
В двух словах: у атопиков избыточно активный иммунитет, который вызывает воспалительные реакции и запускает патологический путь: зуд - расчесывание - больше зуда. Моноклональные антитела позволяют точечно воздействовать на звенья патогенеза, прерывая развитие воспалительной реакции, что клинически характеризуется ремиссией. Чем точнее воздействие на конкретное звено иммунитета, тем меньше риск побочных эффектов. Воздействие препаратов отражено на рисунке.
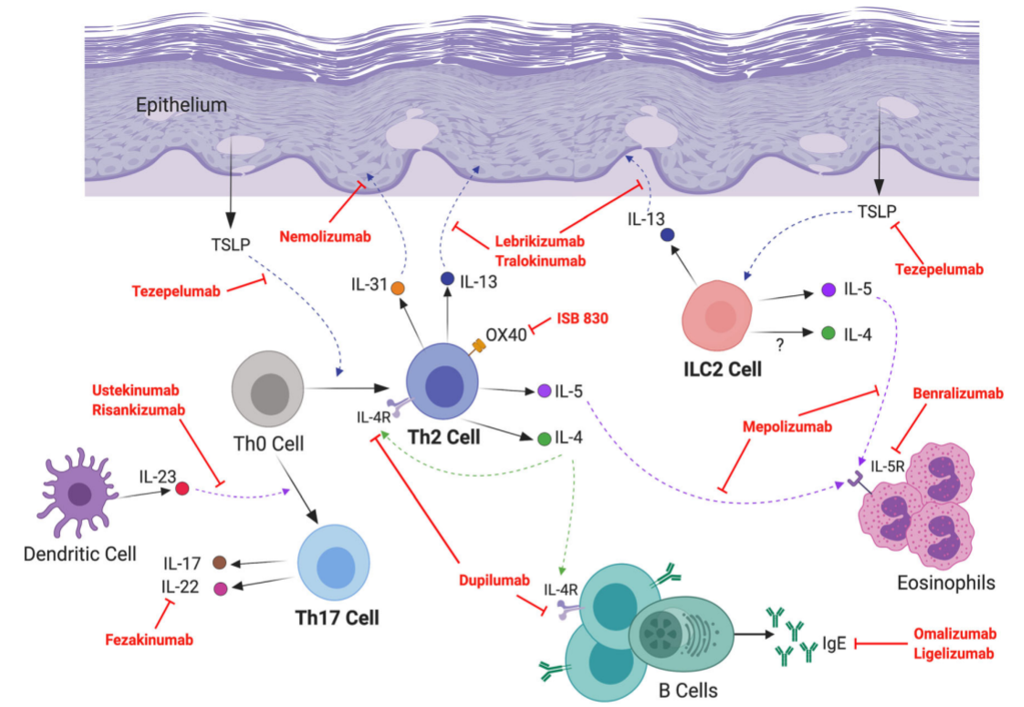
А теперь подробно:
Наблюдается дисрегуляция местных иммунных реакций, воздействие на которые лежит в основе большинства новых целевых терапевтических подходов. Папулы при АД имеют клеточный инфильтрат, состоящий в основном из CD4 + Т-клеток, которые являются основными движущими силами воспаления, и повышенного количества дендритных клеток, включая клетки Лангерганса, которые распространяют свои дендриты через плотные соединения для поглощения антигена.
Нарушение кератиноцитов, в том числе за счет расчесывания и воздействия окружающей среды, приводит к высвобождению кератиноцитами хемокинов (веществ привлекающих клетки иммунитета). Эти медиаторы активируют в коже лимфоидные клетки 2-го типа и клетки TH2 для выработки ключевых воспалительных цитокинов: IL-13 и IL-4.
Хемокины также побуждают дендритные клетки экспрессировать лиганд OX40, который связывается с OX40 на Т-клетках, чтобы дополнительно стимулировать IL-4, IL-5, IL-13 и зуд-специфический цитокин, IL-31. Подсемейство IL-36 и его рецептор IL-36R экспрессируются в коже (и эпителии бронхов) и увеличиваются при АД, хотя и не до такой степени, как при бляшечном или пустулезном псориазе. S aureus является признанным раздражителем кожных IL-36α и IL-36γ, которые активируют передачу сигналов TH17 и их усиление.
Повышенная кожная экспрессия цитокинов и хемокинов TH2 универсальна у пациентов с АД и напрямую способствует воспалению тканей, нарушает эпидермальный барьер за счет подавления экспрессии белков дифференцировки и синтеза липидов. IL-22 cпособствует гиперпролиферации эпидермиса. Повышенная регуляция других путей Т-хелперных клеток неоднородна и связана с определенными популяциями пациентов (TH1 у светлокожих взрослых, TH17 у младенцев, детей и пациентов азиатского происхождения).
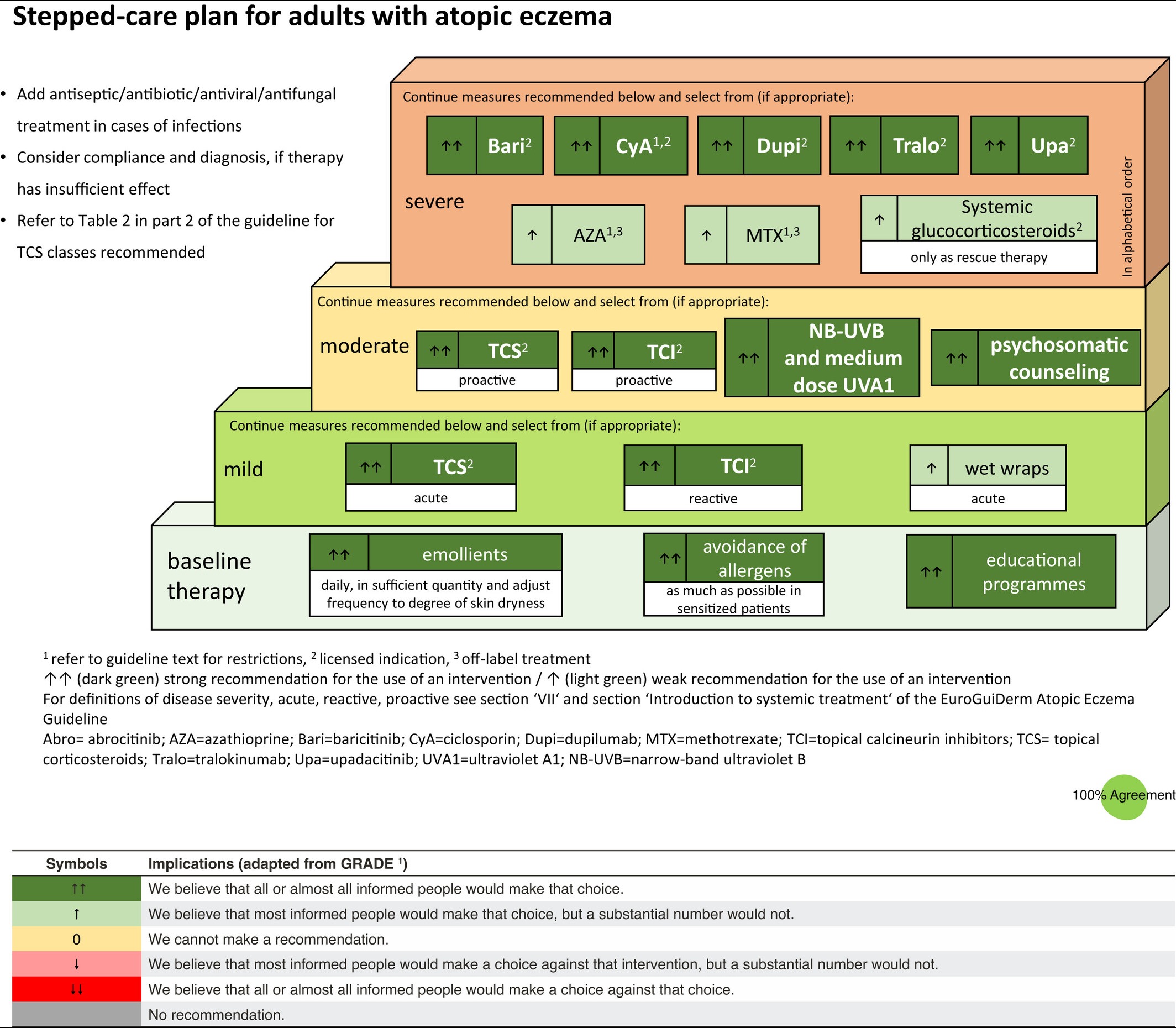
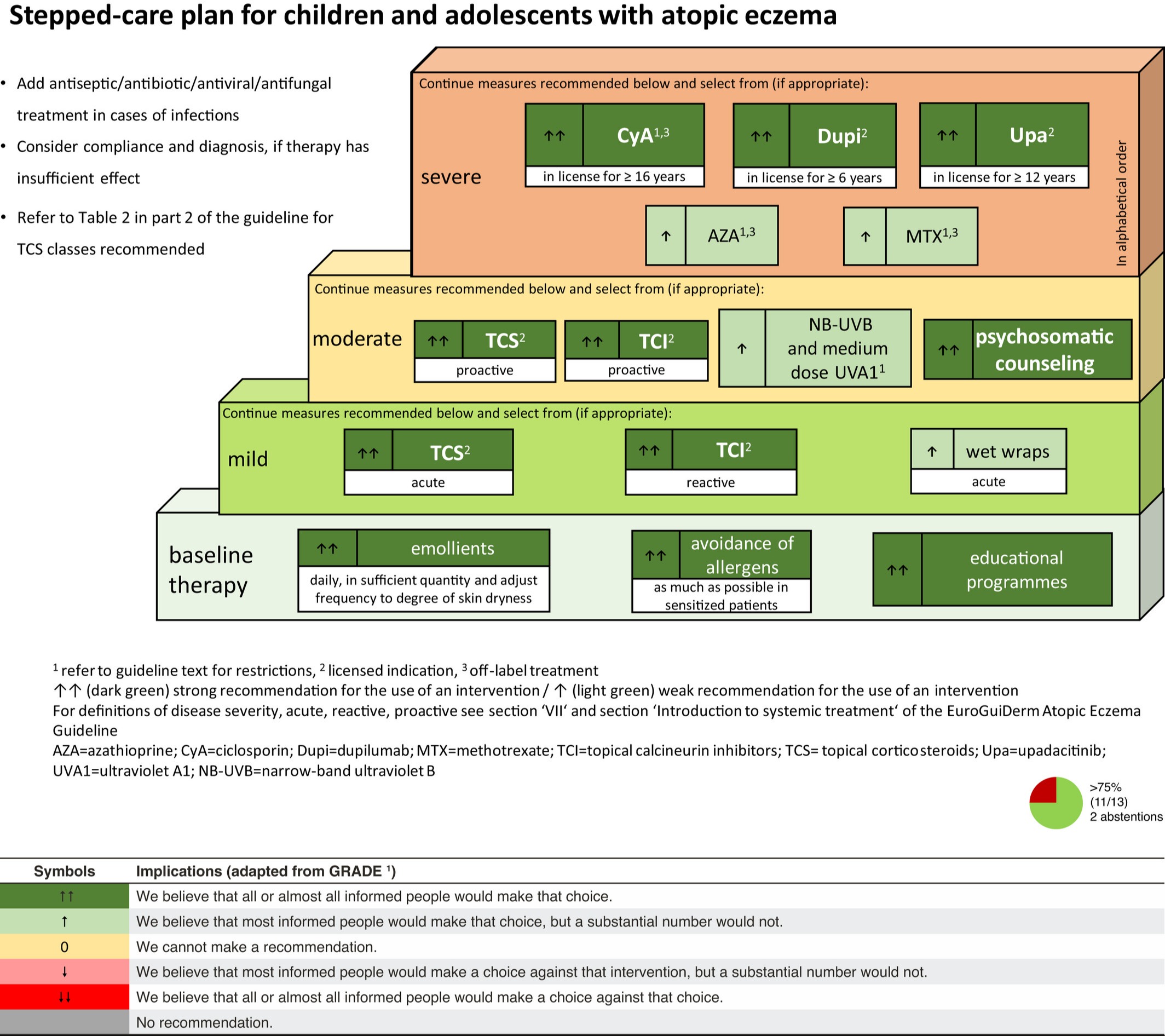
Показания к назначению биологических препаратов.
По российским клиническим рекомендациям, которыми обязан руководствоваться врач дерматовенеролог системная терапия биологическими препаратами показана при средней и тяжелой степени тяжести, при отсутствии противопоказаний препаратом: дупилумаб. Противопоказанием к назначению дупилумаба больным атопическим дерматитом является детский возраст до 12 лет.
Европейские клинические рекомендации несколько расширяют выбор препаратов. При тяжелой степени тяжести у детей и взрослых предлагается использовать: дупилумаб или тралокинумаб, а так же ингибиторы янус-киназ только у взрослых: барицитиниб или упадацитиниб.
Однако по всему миру публикуются статьи рассказывающие об опыте применения других моноклональных антител для лечения атопического дерматита. Подробнее о них написано ниже.
Анализы при лечении биологическими препаратами
Для назначений ГИБП необходимо обследование в объеме:
1. Общий анализ крови с лейкоцитарной формулой и СОЭ.
2. Биохимический анализ крови (общий белок, белковые фракции; мочевина; креатинин; билирубин общий; АсАТ, АлАТ; щелочную фосфатазу, глюкозу или гликированный гемоглобин).
3. Анализ крови на: HbsAg (гепатит В);anti-HCV (гепатит С); сифилис; ВИЧ-инфекцию.
4. Общий анализ мочи.
5. Консультация фтизиатра с заключением. Фтизиатру потребуется обследование:
- Проведение Диаскинтеста;
- Проведение рентгенографии органов грудной клетки в 2 проекциях и/или компьютерной томографии органов грудной клетки.
Для женщин консультация гинеколога для исключения беременности.
На фоне терапии обследование рекомендуется повторять каждые 6 месяцев.
Какие биологические препараты используются для лечения атопического дерматита
Моноклональное антитело против IL-4Rα
Ключевой особенностью атопического дерматита является повышение содержание IL-13 и L-4 в пораженной и не поврежденной коже, а полиморфизмы в генах, кодирующих IL-4 и IL-13, также связаны с атопическим дерматитом.
Дупилумаб представляет собой моноклональное антитело против IL-4Rα, которое является компонентом рецептора IL-4 и рецептора IL13. Дупилумаб был одобрен для использования при атопическом дерматите в марте 2017 года как первое моноклональное антитело, лицензированное для использования при АД. Было обнаружено, что дупилумаб очень эффективен для лечения атопического дерматита средней и тяжелой степени. Фаза 3 испытаний состояла из двух рандомизированных двойных слепых плацебо-контролируемых испытаний в параллельных группах с идентичным дизайном у взрослых с умеренным и тяжелым атопическим дерматитом в Северной Америке, Европе и Азии (SOLO 1 и SOLO 2). Дупилумаб использовался в качестве монотерапии, пациенты прекратили использование любых местных стероидов, ингибиторов кальциневрина, иммуномодулирующих биологических агентов, системных стероидов и нестероидных системных иммунодепрессантов.
Профиль безопасности дупилумаба в этих исследованиях оказался хорошим. Серьезных нежелательных явлений не наблюдалось чаще, чем для плацебо, и большинство других нежелательных явлений также возникали с той же частотой, что и плацебо. Конъюнктивит (аллергическая или неустановленная причина) чаще регистрировался у участников, получавших дупилумаб, по сравнению с плацебо, как и реакции в месте инъекции.
Моноклональное антитело против IL-31
IL-31 продуцируется Т-клетками и является важным медиатором зуда при атопическом дерматите за счет связывания рецептора IL-31A, расположенного на сенсорных нейронах кожи. IL-31 также может быть вовлечен в нарушение физического кожного барьера при атопическом дерматите.
Немолизумаб, антитело против рецептора IL-31 α, показал многообещающие результаты клинических испытаний. Ежемесячные инъекции немолизумаба значительно подавляли зуд у пациентов с умеренной и тяжелой формой АтД в ходе 12-недельного клинического исследования фазы 2. Исследование 3 фазы продолжается.
Anti-IL-13
Лебрикизумаб связывает растворимый IL-13, чтобы предотвратить передачу сигнала через рецептор IL-4. В фазе 2 исследования, лебрикизумаб в дозе 250 мг каждые 2 недели превосходил плацебо для IGA0/1 (44,6% против 15,3%), EASI75 (60,6% против 24,3%).
Тралокинумаб также напрямую связывает IL-13. В 2 параллельных 16-недельных исследованиях, взрослые получавшие 300 мг тралокинумаба каждые 2 недели, достигли IGA0/1 у 15,8% и 22,2% соответственно по сравнению с 7,1% и 10,9% в контрольной группе. Значительно более высокие ответы EASI75 (25% и 33,2% по сравнению с 12,7% и 11,4%).
Анти-IgE-моноклональные антитела.
Омализумаб в качестве моноклонального антитела против IgE был исследован на предмет использования при атопическом дерматите. Однако его эффективность при этом состоянии была сомнительной. Клиническое улучшение и улучшение показателей EASI (площадь и индекс тяжести экземы) или SCORAD (оценка атопического дерматита) и показателей качества жизни были описаны в различных сериях случаев. Однако два рандомизированных контролируемых исследования, также очень небольших по размеру, не продемонстрировали эффективность омализумаба при атопическом дерматите.
Heil et al. продемонстрировали, что лечение омализумабом привело к уменьшению количества IgE по сравнению с контрольной группой, но без существенной разницы в клинической картине заболевания. Айенгар и др. продемонстрировали снижение сывороточных концентраций цитокинов TARC, TSLP, OX40L и IL-9 у детей с атопическим дерматитом, получавших омализумаб, по сравнению с детьми, получавшими плацебо. Однако клинические исходы, измеренные с помощью SCORAD, были схожими для получавших гомализумаб и плацебо.
Ингибиторы ФНО.
Данных об систематическом применении ингибиторов ФНО-а для лечения атопического дерматита с положительным эффектом недостаточно. Немногочисленные серии случаев применения ингибиторов ФНО при атопическом дерматите дали неутешительные результаты. Jacobi et al. испытывали инфликсимаб у девяти пациентов с резистентным к лечению атопическим дерматитом. Все девять пациентов испытали первоначальное улучшение во время индукционной фазы терапии, но только у двух из девяти пациентов наблюдалось устойчивое улучшение во время поддерживающей фазы. Кассано и др. описали длительный контроль симптомов при применении инфликсимаба у одного взрослого пациента с тяжелым дерматитом. Бука и др. описали отсутствие эффективности этанерцепта в двух случаях детского атопического дерматита, в то время как Rullan et al. сообщили о клиническом улучшении хронического атопического дерматита у двух других пациентов, получавших этанерцепт.
Моноклональное антитело против CD20.
Ритуксимаб - моноклональное антитело против CD20, предназначенное для избирательного уничтожения В-клеток, но не затрагивая уже существующие долгоживущие продуцирующие антитела плазматические клетки. В нескольких небольших сериях случаев описывалось использование ритуксимаба при резистентном к лечению атопическом дерматите. Simonet al. описали шесть пациентов с клиническим улучшением показателей после двух внутривенных инфузий ритуксимаба 1000 мг с интервалом в 2 недели. Sediva et al. описали двух пациентов, получивших две дозы ритуксимаба по 500 мг с интервалом в 2 недели; у одного пациента SCORAD улучшился, а у другого ухудшился. McDonald et al. сообщили об отсутствии эффективности ритуксимаба у трех взрослых людей с тяжелым, резистентным к лечению атопическим дерматитом.
Моноклональное антитело против Il5.
Эозинофилы хорошо известны как компонент воспалительного инфильтрата как при остром, так и при хроническом атопическом дерматите. Эозинофилы в тканях обнаруживаются в активированном состоянии, высвобождая содержимое гранул, включая катионный белок эозинофилов и нейротоксин, полученный из эозинофилов. Повышенные уровни этих белков коррелируют с активностью болезни при АД, а снижение уровней связано с клиническим улучшением при АД. Основываясь на этих результатах, биологическая терапия, направленная на эозинофильное воспаление, а именно терапия анти-IL5, считалась потенциальным лечением атопического дерматита.
В настоящее время на рынке представлено несколько биологических препаратов, нацеленных на IL-5, включая меполизумаб, реслизумаб и бенрализумаб. Из них только меполизумаб изучался в клинических испытаниях для лечения атопического дерматита, но подтвердить его ээффективность не удалось. В рандомизированное двойное слепое плацебо-контролируемое исследование меполизумаба в параллельных группах с января по июль 2002 г. было включено 43 исследования, пациенты в возрасте 18–57 лет с атопическим дерматитом.
Три пациента (2 из группы меполизумаба и 1 из группы плацебо) выбыли до 14 дней из-за обострения АД или отсутствия терапевтического ответа. Хотя в группе меполизумаба наблюдалось значительное снижение уровня эозинофилов в крови, это не коррелировало с улучшением клинического состояния.
Из-за отсутствия успеха в использовании меполизумаба до настоящего времени при лечении атопического дерматита в настоящее время продолжаются клинические испытания второй фазы бенрализумаба при атопическом дерматите.
Анти-TSLP-терапия
Тимический стромальный лимфопоэтин (TSLP) - это цитокин, продуцируемый кератиноцитами. Он заставляет дендритные клетки способствовать поляризации Th2, вероятно, действуя как переключатель, включающий аллергическое воспаление. TSLP также действует непосредственно на определенные кожные сенсорные нейроны, способствуя зуду при БА. Есть свидетельства того, что TSLP может запускать начало AD в детстве, а также стимулировать атопический марш к развитию дальнейших атопических заболеваний.
Тезепелумаб - это антитело против TSLP, которое оценивается как средство для лечения атопического дерматита. В исследовании фазы 2а атопического дерматита у взрослых не удалось достичь своей основной конечной точки, превосходства над плацебо в EASI50, но тезепелумаб продолжает изучаться в качестве средства лечения атопического дерматита и находится в исследовании фазы 2b, изучающем его использование в качестве монотерапии при средней и тяжелой степени тяжести.
Anti-OX40
OX40 (CD134) - костимулирующая молекула суперсемейства рецепторов TNF, обнаруживаемая на эффекторных Т-клетках и регуляторных Т-клетках. Лиганд OX40 (OX40L; CD252) экспрессируется на активированных антигенпрезентирующих клетках, и взаимодействие OX40 с его лигандом усиливает эффекторные Т-клеточные ответы, запускаемые через Т-клеточный рецептор. В коже пациентов с АД количество дендритных клеток OX40L увеличено по сравнению с псориатической и нормальной кожей.
Недавно было опубликовано клиническое испытание фазы 2а гуманизированного mAb IgG1 под кодовым названием GBR 830, нацеленного на OX40. В этом рандомизированном двойном слепом плацебо контролируемом исследовании пациенты с АД умеренной и тяжелой формы получали 10 мг / кг внутривенно GBR 830 или плацебо. 46 пациентов получали исследуемый препарат на 1-й и 29-й день и находились под наблюдением до 85-го дня. Биопсии собирали на 1-й день до лечения, после лечения на 29-й и / или 71-й день. Также изучали изменение биомаркеров (эпидермальная гиперплазия / экспрессия мРНК цитокинов) по сравнению с исходным уровнем.
Было обнаружено, что GBR 830 хорошо переносится с аналогичными общими побочными эффектами, возникающими при лечении, по сравнению с плацебо. Инфекция возникли у четырех субъектов в группе GBR 830, одна из этих инфекций - после удаления зуба, другие три были вторичной инфекцией на участке биопсии кожи. Напротив, в группе плацебо постпроцедурных инфекций не было.
Показатели эпидермальной гиперплазии на 71-й день были значительно ниже в группе GBR 830 по сравнению с плацебо, наблюдалось значительное снижение эпидермальной гиперплазии по сравнению с исходным уровнем на 29-й и 71-й день, биопсия поражений после GBR 830 показала значительное снижение нескольких мРНК Th1- (INF-γ), Th2- (CCL11 и CCL17) и связанных с Th17 (IL-23p19 и S100A12). На 71 день в группе GBR830 была большая доля пациентов, достигших 50% или более улучшения EASI по сравнению с плацебо (76,9% против 37,5% соответственно). GBR 830 (теперь называется ISB 830) проходит фазу 2b клинических испытаний при атопическом дерматите.
Моноклональное антитело против IL-22
Атопический дерматит часто упрощенно считают воспалительным заболеванием, опосредованным экспрессией цитокинов Th17-пути, при этом уровни IL-22 соответствуют тяжести заболевания.
Фезакинумаб представляет собой моноклональное антитело против IL-22, которое исследуется на предмет использования при атопическом дерматите. В плацебо-контролируемом исследовании фазы 2 фезакинумаб исследовали у взрослых с неконтролируемым атопическим дерматитом в течение 20 недель, с дозировкой 600 мг в начале исследования, а затем по 300 мг каждые 2 недели до 10-й недели. По сравнению с плацебо у субъектов в группе фезакинумаба наблюдалось значительно большее снижение SCORAD по сравнению с исходным уровнем в течение недель с 6 по 10. Однако первичная конечная точка значительно снижения SCORAD по сравнению с исходным уровнем на 12 неделе не была достигнута. Вторичные конечные точки SCORAD50 и SCORAD75 также не показали статистически значимой разницы по сравнению с плацебо.
Антогонисты IL-12/IL-23p40
Устекинумаб представляет собой антагонист IL-12/IL-23p40, нацеленный на общую субъединицу (p40) для IL-12 и IL-23. Он подавляет активацию Th1, Th17 и Th22 и одобрен FDA для использования при псориазе. Он был испытан при хроническом атопическом дерматите у взрослых, но исследования не показали его эффективности. Во второй фазе плацебо-контролируемого двойного слепого одноцентрового клинического исследования 33 пациента, страдающих атопическим дерматитом средней и тяжелой степени, получали устекинумаб или плацебо, а затем через 16 недель перешли на другую группу терапии. Первичной конечной точкой был SCORAD50 через 16 недель (доля участников, достигших 50% улучшения по сравнению с исходным уровнем по SCORAD). Несколько более высокие показатели SCORAD50 в группе устекинумаба по сравнению с плацебо были обнаружены на 12-й, 16-й и 20-й неделе, но это не было статистически значимым.